Dans le cadre des Travaux Pratiques Encadrés (TPE), trois élèves de Première scientifique, L. Daguet, N. Moreau et C. Vivier, se sont intéressées aux feux d’artifice. Elles ont répondu à la problématique suivante : « Qu’est-ce qui permet d’envoyer une chandelle verte à 30 m de hauteur ? » Voici un aperçu de leur travail que vous pouvez découvrir dans sa globalité en pièce jointe.
Les recherches que nous avons effectuées nous ont permis de répondre à notre problématique : « Qu’est ce qui permet d’envoyer une chandelle verte à 30 mètres de hauteur ? ». Les différents phénomènes scientifiques qui interviennent pour propulser cette chandelle à 30 mètres de hauteur et émettre une couleur verte sont la combustion, l’oxydoréduction, la propulsion par réaction et l’émission de lumière. Cependant, il ne faut pas oublier que tout le monde ne peut pas tirer des chandelles et des feux d’artifice sans un minimum de qualifications, car cela peut être très dangereux si on ne respecte pas les mesures de sécurité, qui sont très nombreuses.
Voici la composition d’une chandelle :
Les recherches que nous avons effectuées nous ont permis de répondre à notre problématique : « Qu’est ce qui permet d’envoyer une chandelle verte à 30 mètres de hauteur ? ». Les différents phénomènes scientifiques qui interviennent pour propulser cette chandelle à 30 mètres de hauteur et émettre une couleur verte sont la combustion, l’oxydoréduction, la propulsion par réaction et l’émission de lumière. Cependant, il ne faut pas oublier que tout le monde ne peut pas tirer des chandelles et des feux d’artifice sans un minimum de qualifications, car cela peut être très dangereux si on ne respecte pas les mesures de sécurité, qui sont très nombreuses.
Voici la composition d’une chandelle :
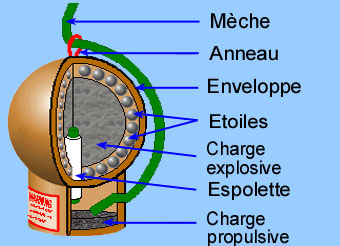
La partie explosive est une enveloppe en carton ou plastique, de forme sphérique ou cylindrique. Elle contient une charge explosive, la poudre noire, qui permet de faire exploser la charge. Autour, il y a des « étoiles » qui sont des sortes de billes de poudre noire compactée. La partie propulsive est une enveloppe qui contient une charge de poudre propulsive. La liaison entre ces deux parties est une mèche retard (l’espolette).
Le composant de base des feux d’artifice est la poudre noire qui est un mélange de charbon (15%), de salpêtre (75%) et de nitrate (10%). Pour obtenir les différentes couleurs, on y mélange du baryum, du strontium, du sodium et du magnésium. Pour 215 g de poudre, une chandelle de calibre 30 mm va monter à 30 m d’altitude.
Dans un feu d’artifice, il y a combustion de la poudre noire, de formule KNO3+S+C. Le KNO3 est du nitrate de potassium, le S est du soufre et le C du carbone. L’équation chimique de cette combustion est : 2KNO3+S+3C → K2S+3CO2+N2. Ici, le combustible est le soufre et le comburant est le nitrate de potassium. Le produit stable formé pendant la réaction d’oxydoréduction est le dioxyde de carbone CO2.
La loi de Boyle-Mariotte dit : « À volume constant, la pression augmente proportionnellement à la température ». Dans le cas des feux d’artifice, le volume est constant, c’est le mortier. La pression augmente donc proportionnellement à la température. La température est décuplée très rapidement, donc la pression devient énorme. Ces deux éléments créent l’un des facteurs les plus importants de la propulsion : la vitesse.
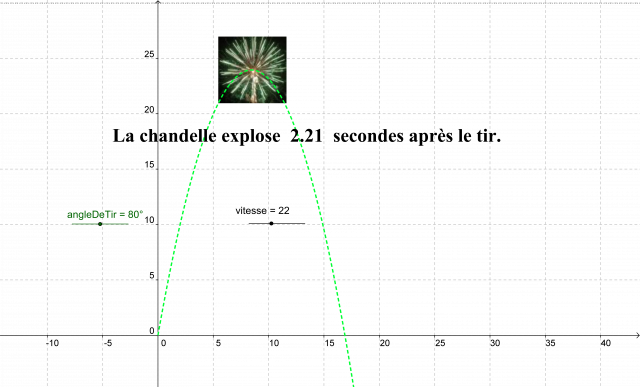
Nous avons modélisé, en utilisant le logiciel de géométrie dynamique Geogebra, la trajectoire d’une chandelle en fonction de l’angle de tir et de la vitesse initiale.
Le composant de base des feux d’artifice est la poudre noire qui est un mélange de charbon (15%), de salpêtre (75%) et de nitrate (10%). Pour obtenir les différentes couleurs, on y mélange du baryum, du strontium, du sodium et du magnésium. Pour 215 g de poudre, une chandelle de calibre 30 mm va monter à 30 m d’altitude.
Dans un feu d’artifice, il y a combustion de la poudre noire, de formule KNO3+S+C. Le KNO3 est du nitrate de potassium, le S est du soufre et le C du carbone. L’équation chimique de cette combustion est : 2KNO3+S+3C → K2S+3CO2+N2. Ici, le combustible est le soufre et le comburant est le nitrate de potassium. Le produit stable formé pendant la réaction d’oxydoréduction est le dioxyde de carbone CO2.
La loi de Boyle-Mariotte dit : « À volume constant, la pression augmente proportionnellement à la température ». Dans le cas des feux d’artifice, le volume est constant, c’est le mortier. La pression augmente donc proportionnellement à la température. La température est décuplée très rapidement, donc la pression devient énorme. Ces deux éléments créent l’un des facteurs les plus importants de la propulsion : la vitesse.
Nous avons modélisé, en utilisant le logiciel de géométrie dynamique Geogebra, la trajectoire d’une chandelle en fonction de l’angle de tir et de la vitesse initiale.

L’énergie est alors apportée à l’espolette qui se consume avec une flamme. Lorsque la bombe se trouve à son apogée dans le ciel, la flamme de l’espolette arrive à la charge d’éclatement qui, semblablement à la chasse, dégage beaucoup de gaz dans un volume restreint ainsi qu’une chaleur énorme. Cela provoque alors une explosion. À l’intérieur de la bombe, les étoiles reparties autour de la charge d’éclatement sont alors dispersées dans le ciel, elles ont reçu la chaleur produite par la combustion de la poudre noire.
Nous avons réalisé une expérience visant à expérimenter les effets de différentes poudres utilisées dans les feux d’artifice sur la flamme d’un bec bunsen.
Nous avons réalisé une expérience visant à expérimenter les effets de différentes poudres utilisées dans les feux d’artifice sur la flamme d’un bec bunsen.
Expérience avec le baryum.
On voit que le chlorure de baryum donne du vert. Le vert est obtenu par émission moléculaire du chlorure de baryum. Pour notre chandelle, il faut donc ajouter à la poudre noire du chlorure de baryum pour qu’elle soit de couleur verte.
Expérience avec du sulfate d’aluminium.
Le sulfate d’aluminium donne des étincelles.